ULTOMIRIS® is the first and only long-acting C5 inhibitor that is administered every 8 weeks1,2,4,5.





*With ULTOMIRIS® 300 mg/3 mL or 1,100 mg/11 mL concentrate for solution for infusion. Starting 2 weeks after the loading dose, maintenance doses are administered once every 8 weeks. For patients ≥10 to <20 kg, maintenance doses are administered once every 4 weeks.
Mechanism of action
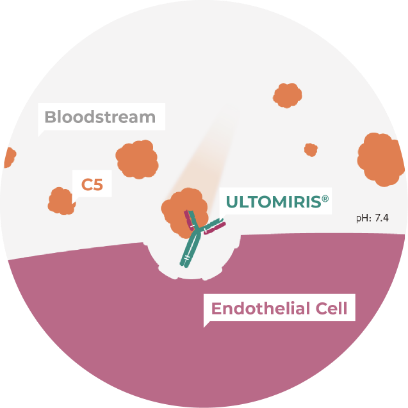
ULTOMIRIS® (ravulizumab) traps C5 in the bloodstream and prevents its activation11
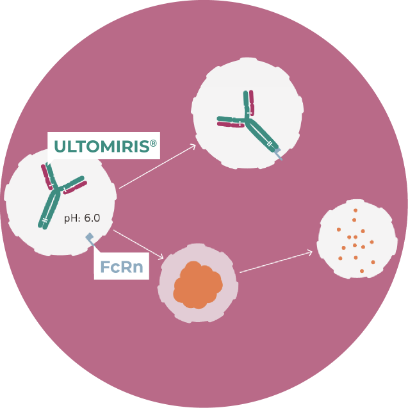
Specially designed, ULTOMIRIS® (ravulizumab) deposits C5 in the acidified endosome, allowing the C5 from the lysosome can be broken down. The acidified environment also improves the binding affinity of ULTOMIRIS® to the neonatal Fc receptor (FcRn) and promotes its return to the cell surface via FcRn-mediated recycling11
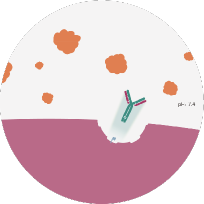
FcRn releases unbound ULTOMIRIS® (ravulizumab) ravulizumab back into the bloodstream in order to increase C5 uptake11

Comprehensive clinical development programme
The effectiveness of ULTOMIRIS® was investigated in the largest clinical study to date of PNH patients4,5,8,9,13
ULTOMIRIS® for the treatment of PNH in adult patients who are complement therapy treatment-naive.4,9,13
ULTOMIRIS® for the treatment of PNH in adult patients previously treated with Eculizumab.5,8,13

Resources
Use of anticoagulants in PNH
Discover why anticoagulants are not sufficient in PNH
IVH, intravascular haemolysis; LDH, lactate dehydrogenase; PNH, paraoxysmal nocturnal haemoglobinuria; ULN, upper limit of normal.
References:
- ULTOMIRIS® Summary of Product Characteristics, July 2023.
- Ristano AM, Marotta S. Toward complement inhibition 2.0: Next generation anticomplement agents for paroxysmal nocturnal hemoglobinuria. Am J Hematol. 2018;93(4):564-577.
- SOLIRIS® EU Summary of Product Characteristics. August 2023.
- Lee JW, et al. Ravulizumab (ALXN1210) vs eculizumab in adult patients with PNH naive to complement inhibitors: the 301 study. Blood. 2019;133(6):530-539.
- Kulasekararaj AG, et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor-experienced adult patients with PNH: the 302 study. Blood. 2019;133(6):540-549.
- Kelly R, Richards S, Hillmen P, Hill A. The pathophysiology of paroxysmal nocturnal hemoglobinuria and treatment with eculizumab. Ther Clin Risk Manag. 2009;5:911-921.
- Jang JH, et al. Predictive Factors of Mortality in Population of Patients with Paroxysmal Nocturnal Hemoglobinuria (PNH): Results from a Korean PNH Registry. J Korean Med Sci. 2016;31(2):214–221.
- Kulasekararaj AG, et al. One-year outcomes from a phase 3 randomized trial of ravulizumab in adults with paroxysmal nocturnal hemoglobinuria who received prior eculizumab. Eur J Haematol. 2021 Mar;106(3):389-397.
- Schrezenmeier H, Kulasekararaj A, Mitchell L, et al. One- year efficacy and safety of ravulizumab in adults with paroxysmal nocturnal hemoglobinuria naive to complement inhibitor therapy: open-label extension of a randomized study. Ther Adv Hematol. 2020:11:20406207209661372019;133(6):540-549.
- Peipert JD, et al. Patient preferences and quality of life implications of ravulizumab (every 8 weeks) and eculizumab (every 2 weeks) for the treatment of paroxysmal nocturnal hemoglobinuria. PLoS ONE. 2020;15(9): e0237497
- Sheridan D, et al. Design and preclinical characterization of ALXN1210: A novel anti-C5 antibody with extended duration of action. PLoS One. 2018 Apr 12;13(4):e0195909.
- Risitano AM, et al. Anti-complement Treatment for Paroxysmal Nocturnal Hemoglobinuria: Time for Proximal Complement Inhibition? A Position Paper From the SAAWP of the EBMT. Front Immunol. 2019;10:1157.
- Kulasekararaj AG, et al. Long-term safety and efficacy of ravulizumab in patients with paroxysmal nocturnal hemoglobinuria: 2-year results from two pivotal phase 3 studies. Eur J Haematol. 2022 Sep;109(3):205-214.
Produktinformation. Ultomiris (ravulizumab): Ultomiris 300 mg/3 ml koncentrat til infusionsvæske, opløsning og Ultomiris 1.100 mg/11 ml koncentrat til infusionsvæske, opløsning. Denne produktinformation er omskrevet/forkortet i forhold til det af Det Europæiske Lægemiddelagentur godkendte produktresumé dateret 05 May 2023. Produktresumeet kan vederlagsfrit rekvireres fra indehaveren af markedsføringstilladelsen eller findes på Det Europæiske Lægemiddelagenturs hjemmeside: http://www.ema.europa.eu/ema/. LÆS PRODUKTRESUMÉET FØR ORDINATION, ISÆR MED HENSYN TIL DOSERING, BIVIRKNINGER, ADVARSLER OG KONTRAINDIKATIONER
Indikationer: Ultomiris er indiceret til behandling af voksne og pædiatriske patienter med en kropsvægt på 10 kg eller derover med paroksystisk nokturn hæmoglobinuri (PNH): hos patienter med hæmolyse med klinisk(e) symptom(er), der tyder på høj sygdomsaktivitet, og hos patienter, der er klinisk stabile efter behandling med eculizumab i mindst de sidste 6 måneder. Ultomiris er indiceret til behandling af patienter med en kropsvægt på 10 kg eller derover med atypisk hæmolytisk uræmisk syndrom (aHUS), som er behandlingsnaive i forhold til komplementhæmmer, eller som har fået eculizumab i mindst 3 måneder og har evidens for respons på eculizumab. Ultomiris er indiceret som et supplement til standardterapi ved behandling af voksne patienter med generaliseret myasthenia gravis (gMG), som er anti-acetylcholinreceptor (AChR)-antistofpositive. Ultomiris is indiceret til behandling af voksne patienter med NMOSD, som er anti-aquaporin 4 (AQP4)-antistofpositive Kontraindikationer: Overfølsomhed over for det aktive stof eller over for hjælpestoffer. Patienter med en Neisseria meningitidis-infektion, som ikke har fortaget sig ved behandlingsstart. Patienter, som ikke aktuelt er vaccineret mod Neisseria meningitidis, medmindre de får profylaktisk behandling med passende antibiotika indtil 2 uger efter vaccinationen. Dosering: En støddosis efterfulgt af vedligeholdelsesdosering. Doserne er baseret på patientens legemsvægt. For voksne patienter (≥ 18 år) med PNH, aHUS, gMG eller NMOSD og pædiatriske patienter med PNH og aHUS og en legemsvægt ≥ 40 kg skal vedligeholdelsesdoserne administreres i intervaller på én gang hver 8. uge startende 2 uger efter administration af en støddosis. ≥ 40 til < 60 kg: 2.400 mg støddosis, 3.000 mg vedligeholdelsesdosis. ≥ 60 til < 100 kg: 2.700 mg støddosis, 3.300 mg vedligeholdelsesdosis. ≥ 100 kg: 3.000 mg støddosis, 3.600 mg vedligeholdelsesdosis. For pædiatriske patienter med PNH eller aHus og en legemsvægt på ≥ 10 kg til < 40 kg er det vægtbaserede dosisregime: ≥ 10 til < 20 kg: 600 mg støddosis, 600 mg vedligeholdelsesdosis hver 4. uge. ≥ 20 til < 30 kg: 900 mg støddosis, 2100 mg vedligeholdelsesdosis hver 8. uge. ≥ 30 til < 40 kg: 1.200 mg støddosis, 2.700 mg vedligeholdelsesdosis hver 8. uge. Første vedligeholdelsesdosis administreres 2 uger efter støddosen. For patienter, der skifter fra eculizumab til ravulizumab, skal støddosen med ravulizumab administreres 2 uger efter den sidste eculizumab-infusion. En supplerende dosis af ravulizumab er nødvendig i behandlingsforløb med plasmaudveksling, plasmaferese eller intravenøs immunoglobulin, se anbefalingerne i det fuldstændige produktresumé. Ravulizumab er ikke undersøgt hos pædiatriske patienter med PNH, der vejer mindre end 30 kg; doseringen er baseret på den dosering, der anvendes til pædiatriske patienter med aHUS. Administration: Kun til intravenøs infusion. Se instruktioner om fortynding af lægemidlet før administration i produktresuméet. Skal administreres gennem et 0,2 µm filter og må ikke administreres som en hurtig intravenøs injektion eller bolus. Se administrationshastigheder i produktresuméet. Skal administreres af læger og sundhedspersonale med erfaring i hæmatologiske, renale eller neuromuskulære sygdomme. Det er tilladt lejlighedsvis at variere doseringsplanen med ± 7 dage fra den planlagte infusionsdag (undtagen den første vedligeholdelsesdosis af ravulizumab), men den efterfølgende dosis skal administreres i henhold til den oprindelige plan. PNH er en kronisk sygdom, og det anbefales, at behandlingen med ravulizumab fortsætter i hele patientens liv, medmindre en seponering er klinisk indiceret. Ved aHUS skal behandling med ravulizumab til bedring af TMA-manifestationer have en varighed på mindst 6 måneder, hvorefter behandlingsvarigheden skal overvejes individuelt. Patienter med højere risiko for recidiv af TMA kan have behov for kronisk behandling. Hos gMG-patienter er behandling med ravulizumab kun blevet undersøgt i et behandlingsforløb med kronisk administration. Ravulizumab er ikke blevet undersøgt hos gMG-patienter med en MGFA klasse V. Bivirkninger og risici: Særlige advarsler: Navn og batchnummer på det administrerede præparat skal tydeligt registreres. Ravulizumab øger patientens modtagelighed over for Meningokokinfektion/sepsis/encefalitis (Neisseria meningitidis). Der kan opstå meningokoksygdom som følge af en hvilken som helst serogruppe. For at nedsætte denne infektionsrisiko skal alle patienter vaccineres mod meningokokinfektioner mindst to uger før, ravulizumab-behandlingen påbegyndes, medmindre risikoen ved at forsinke ravulizumab-behandling opvejer risikoen for at udvikle en meningokokinfektion. Patienter, som påbegynder behandling med ravulizumab mindre end 2 uger efter, at de har fået en meningokokvaccine, skal behandles med passende profylaktisk antibiotika indtil 2 uger efter vaccination. Vacciner mod serogrupper A, C, Y, W135 og B, hvor det er muligt, anbefales til forebyggelse af de almindeligvis patogene meningokok serogrupper. Patienterne skal vaccineres eller revaccineres i henhold til de gældende nationale retningslinjer. Hvis patienten skiftes fra eculizumab-behandling skal lægerne verificere, at meningokokvaccinationen stadig dækker. Alle patienter skal overvåges for tidlige tegn på meningokokinfektion og sepsis og straks evalueres, hvis der er mistanke om en infektion, og behandles med passende antibiotika. Patienterne skal informeres om disse tegn og symptomer, og der skal straks søges lægehjælp. Patienter skal overvåges nøje for sygdomssymptomer efter den anbefalede vaccination, eftersom de kan få forøgede tegn og symptomer på deres underliggende sygdom, såsom hæmolyse. Patienter under 18 år skal vaccineres mod Haemophilus influenzae og pneumokokinfektioner og skal nøje overholde det nationale vaccinationsprograms anbefalinger for den enkelte aldersgruppe. Administreres med forsigtighed hos patienter med aktive systemiske infektioner. Patienterne kan have en øget modtagelighed for infektioner forårsaget af Neisseria–arter og indkapslede bakterier. Alvorlige infektioner med Neisseria-arter (ud over Neisseria meningitidis), herunder disseminerede gonokokinfektioner, er blevet rapporteret. Patienterne skal via indlægssedlen informeres om at øge deres opmærksomhed på mulige alvorlige infektioner og deres tegn og symptomer. Læger skal rådgive patienter om forebyggelse af gonorré. Administration kan føre til infusionsreaktioner og allergiske reaktioner eller overfølsomhedsreaktioner (herunder anafylaksi). I tilfælde af infusionsreaktioner skal ravulizumab-infusionen afbrydes, og der skal iværksættes passende støtteforanstaltninger, hvis der opstår tegn på kardiovaskulær ustabilitet eller respirationshæmning. Hvis patienter med PNH seponerer behandlingen med ravulizumab, skal de overvåges nøje i mindst 16 uger for tegn og symptomer på alvorlig intravaskulær hæmolyse, identificeret ved forhøjede niveauer af LDH (lactatdehydrogenase) med en pludselig reduktion i PNH-klonstørrelse eller hæmoglobin, eller tilbagevenden af symptomer som udmattelse, hæmoglobinuri, abdominalsmerter, stakåndethed, større vaskulære bivirkninger, dysfagi eller erektil dysfunktion. Ved tegn og symptomer på hæmolyse, bør det overvejes at genstarte behandlingen med ravulizumab. Patienter med aHUS, der er nødt til at få seponeret behandlingen med ravulizumab, skal løbende monitoreres tæt for tegn og symptomer på TMA. Hvis der opstår TMA-komplikationer efter seponering af ravulizumab, skal genoptagelse af behandlingen overvejes, begyndende med den anviste støddosis og vedligeholdelsesdosis. Da gMG er en kronisk sygdom, skal patienter, der har gavn af ravulizumab-behandling, som seponerer behandlingen, overvåges for symptomer på den underliggende sygdom. Hvis der forekommer symptomer på gMG efter seponering, skal det overvejes at genstarte behandling med ravulizumab. gMG-patienter, som ikke reagerer på godkendt doseringsregime med eculizumab, bør ikke behandles med ravulizumab. Da NMOSD er en kronisk sygdom, skal patienter, der har gavn af ravulizumab-behandling, som seponerer behandlingen, overvåges for symptomer på NMOSD-recidiv. Hvis der forekommer symptomer på NMOSD-recidiv efter seponering, skal det overvejes at genstarte behandling med ravulizumab. Vær opmærksom på natriumindholdet, se produktresuméet. Kvinder i den fertile alder skal anvende sikre kontraceptionsmetoder under behandlingen og i op til 8 måneder efter behandlingen. Hos gravide kvinder kan det overvejes at bruge ravulizumab efter en vurdering af risici og fordele. Amning skal ophøre under behandling med ravulizumab og i op til 8 måneder efter behandlingen. Interaktioner: Der er ikke udført interaktionsstudier. Bivirkninger: Meget almindelig: Hovedpine, diarré, kvalme, mavesmerter, feber (pyreksi), træthed (udmattelse), infektion af de øvre luftveje, forkølelse (nasofaryngitis), rygsmerter, ledsmerter (artralgi) Almindelig: svimmelhed, opkastning, ubehag i maven efter måltider (dyspepsi), nældefeber, udslæt, kløende hud (pruritus) muskelsmerter (myalgi) og muskelspasmer, influenzalignende sygdom, kulderystelser, svaghed (asteni) infusionsrelateret reaktion, allergisk reaktion (overfølsomhed), urinvejsinfektion. Ikke almindelig: meningokokinfektion, alvorlig allergisk reaktion, som giver vejrtrækningsbesvær eller svimmelhed (anafylaktisk reaktion), gonokokinfektion. Overdosering: Der er endnu ikke rapporteret tilfælde af overdosering. Pakningsstørrelser: 1 hætteglas. Priser: Se dagsaktuelle priser på www.medicinpriser.dk. Generelt tilskud: Nej. Udlevering: BEGR. Indehaver af markedsføringstilladelsen: Alexion Europe SAS, FRANKRIG. Lokal repræsentant: Alexion Pharma Nordics AB, Stockholm, Sverige. Revisionsdato: 13 Juli 2023.



