The first and only long-acting treatment for aHUS, providing1,3,4:
*Through 26 weeks; TMA response consisted of platelet count normalization, Serum LDH normalization and ≥25% improvement in serum creatinine from baseline
†54% (30/56; 95% CI: 40-67%) of adult and 77% (14/18; 95% CI: 52.4-93.6%) of pediatric patients met the composite endpoint of complete TMA response
‡Starting 2 weeks after the loading dose, maintenance doses are administered once every 4 or 8 weeks (depending on body weight)

*ULTOMIRIS® is administered as maintenance dose for patients above 20 kg every 8 weeks.
ULTOMIRIS® Mechanism of Action
With its extended half-life2, ULTOMIRIS® minimises the number of infusions
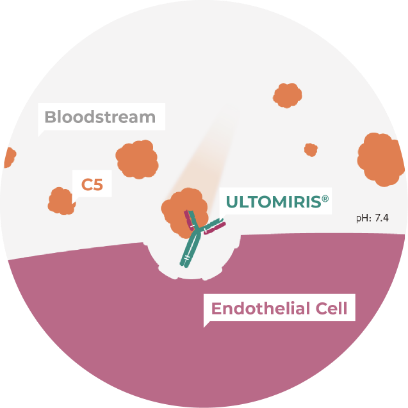
ULTOMIRIS® captures C5 in the bloodstream and prevents its activation2
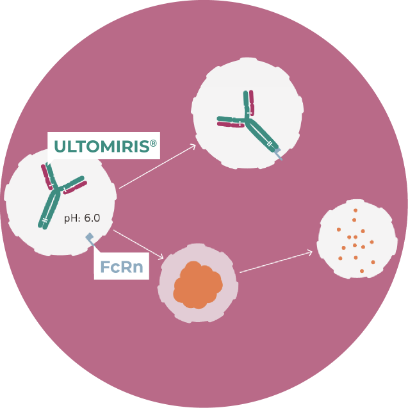
Specifically engineered, ULTOMIRIS® releases C5 in the acidified endosome, leaving C5 to be degraded by the lysosome. This acidified environment also increases the affinity of ULTOMIRIS® for the neonatal Fc receptor (FcRn), enhancing its return to the cell surface via FcRn-mediated recycling2
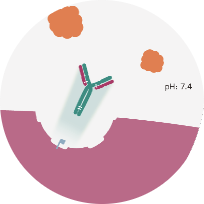
FcRn releases unbound ULTOMIRIS® back into the bloodstream to capture more C52
ULTOMIRIS® captures C5 in the bloodstream and prevents its activation2
Specifically engineered, ULTOMIRIS® releases C5 in the acidified endosome, leaving C5 to be degraded by the lysosome. This acidified environment also increases the affinity of ULTOMIRIS® for the neonatal Fc receptor (FcRn), enhancing its return to the cell surface via FcRn-mediated recycling2
FcRn releases unbound ULTOMIRIS® back into the bloodstream to capture more C52

Ravulizumab has a ~4x longer half-life than that of eculizumab®2§

§§Half-life of ULTOMIRIS® in patients with aHUS is 51.8 (16.2) days; mean elimination half life of eculizumab in aHUS is 12.4 days.

▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta.
Ultomiris (ravulitsumabi)
Ultomiris 300 mg/3 ml ja 1 100 mg/11 ml infuusiokonsentraatti, liuosta varten Käyttöaihe: Ultomiris on tarkoitettu aikuisten ja vähintään 10 kg painavien pediatristen potilaiden paroksysmaalisen nokturnaalisen hemoglobinurian (PNH) hoitoon: - hemolyysipotilailla, joilla on hyvin aktiiviseen sairauteen viittaavia kliinisiä oireita; - potilailla, jotka ovat kliiniseltä tilaltaan vakaita saatuaan hoitoa ekulitsumabilla vähintään viimeisten 6 kuukauden ajan. Ultomiris on tarkoitettu myös epätyypillisen hemolyyttis-ureemisen oireyhtymän (aHUS) hoitoon potilaille, jotka painavat vähintään 10 kg ja jotka eivät aikaisemmin ole saaneet komplementin estäjähoitoa tai jotka ovat saaneet ekulitsumabia vähintään 3 kuukauden ajan ja joilla on näyttöä vasteesta ekulitsumabille (ks. valmisteyhteenveto). Ultomiris on tarkoitettu myös yleistyneen myasthenia graviksen (gMG) tavanomaisen hoidon lisähoidoksi gMG:tä sairastaville aikuisille, jotka ovat positiivisia asetyylikoliinireseptorin (AChR) vasta-aineille. Neuromyelitis optica -kirjon häiriö (NMOSD) Ultomiris on tarkoitettu aikuisille potilaille, joilla on todettu akvaporiini 4:n (AQP4) vastaaineita (ks. kohta 5.1). Annostus ja antotapa: Vain infuusiona laskimoon. Ravulitsumabia saa antaa vain terveydenhuollon ammattilainen veri-, munuais- tai neuromuskulaaristen tautien hoitoon perehtyneen lääkärin valvonnassa. Suositeltu annostusohjelma käsittää latausannoksen ja ylläpitoannoksia. Annosten suuruus määräytyy potilaan painon mukaan. Ylläpitoannokset annetaan aikuispotilaille (≥ 18-vuotiaille) 8 viikon välein. Ensimmäinen ylläpitoannos annetaan 2 viikon kuluttua latausannoksesta. PNH-potilailla ravulitsumabihoitoa on suositeltavaa jatkaa potilaan eliniän ajan, jollei ravulitsumabihoidon lopettaminen ole kliinisesti aiheellista. aHUS-potilailla tromboottisten mikroangiopatiatapahtumien (TMA) hoitoa ravulitsumabilla pitää jatkaa vähintään 6 kuukauden ajan. Tämän jälkeen hoidon kestoa on harkittava yksilöllisesti jokaisen potilaan kohdalla. Ravulitsumabista hyötyviä gMG-potilaita, jotka lopettavat hoidon, on seurattava perussairauden oireiden varalta. Jos gMG:n oireita esiintyy lopettamisen jälkeen, ravulitsumabihoidon uudelleen aloittamista on harkittava. Ravulitsumabia ei suositella gMGpotilaille, jotka eivät reagoi ekulitsumabihoitoon hyväksytyllä annostuksella. gMG-potilailla ravulitsumabia on tutkittu vain pitkäaikaisessa annossa. Ravulitsumabia ei ole tutkittu gMGpotilailla, joiden MGFA-luokka on V. Annostusohjeet ja ohjeet ekulitsumabista ravulitsumabiin vaihtavien potilaiden hoidosta, ks. valmisteyhteenveto. Plasmanvaihdon, plasmafereesin ja laskimonsisäisen immunoglobuliinihoidon (IVIg) -hoidon yhteydessä on tarpeen antaa lisäannos ravulitsumabia. Lisäannosten annostelu ja antonopeus, ks. valmisteyhteenveto. Erityisryhmät: Pediatrisia PNH- ja aHUS-potilaita, joiden paino on ≥ 40 kg, hoidetaan aikuisten annostussuositusten mukaisesti. Annostus pediatrisille aHUS-potilaille, joiden paino on ≥ 10 kg – < 40 kg, ks. valmisteyhteenveto. Ravulitsumabia ei ole tutkittu pediatrisilla gMGpotilailla. Vaihto ekulitsumabista ravulitsumabiin, ks. valmisteyhteenveto. Ravulitsumabia ei ole tutkittu pediatrisilla PNH-potilailla, jotka painavat alle 30 kg, suositus ks. valmisteyhteenveto. Annostuksesta alle 10 kg painaville aHUS-potilaille ei voida antaa suosituksia. Muut erityisryhmät, ks. valmisteyhteenveto. Laimentamisohjeet ja antotapa eri vahvuuksia käytettäessä, ks. valmisteyhteenveto. 300 mg/30 ml vahvuutta ei saa sekoittaa muiden vahvuuksien kanssa. Vasta-aiheet: Yliherkkyys vaikuttavalle aineelle tai apuaineille; hoitamaton Neisseria meningitidis -infektio hoitoa aloitettaessa; potilaat, joilla ei ole voimassa olevaa rokotesuojaa Neisseria meningitidis -infektiota vastaan, elleivät he saa profylaktista hoitoa asianmukaisilla antibiooteilla siihen saakka, kunnes rokotuksesta on kulunut 2 viikkoa. Varoitukset ja varotoimet: Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi. Ravulitsumabi lisää potilaan alttiutta meningokokki-infektiolle/-sepsikselle (kaikki seroryhmät). Kaikki potilaat on rokotettava meningokokki-infektioita vastaan vähintään 2 viikkoa ennen ravulitsumabihoidon aloittamista, ellei ravulitsumabihoidon viivästyttämiseen liittyvä riski ole suurempi kuin meningokokki-infektion riski. Kaikkia potilaita on seurattava meningokokki-infektion ja -sepsiksen varhaisten merkkien varalta. Potilaille tulee kertoa näistä merkeistä ja oireista, ja heitä on neuvottava hakeutumaan lääkärinhoitoon välittömästi, jos niitä esiintyy. Rokotukset, ks. valmisteyhteenveto. Ravulitsumabihoito on annettava varoen potilaille, joilla on aktiivisia systeemisiä infektioita. Lääkärien tulee neuvoa potilaita tippurin ehkäisyssä. Ravulitsumabin anto saattaa aiheuttaa infuusio-, allergisia tai yliherkkyysreaktioita (mukaan lukien anafylaksiaa).; toimintaohjeet, ks. valmisteyhteenveto. PNH-potilaita, jotka lopettavat ravulitsumabihoidon, tulee seurata vähintään 16 viikon ajan hemolyysin ja muiden reaktioiden havaitsemiseksi. Jos aHUS-potilaan ravulitsumabihoito on lopetettava, potilasta on seurattava huolellisesti ja jatkuvasti TMA: n oireiden ja löydösten varalta. Seuranta ei kuitenkaan välttämättä riitä vaikeiden TMA-komplikaatioiden ennustamiseen tai ehkäisyyn. Tarkemmat tiedot, ks. valmisteyhteenveto. Sisältää natriumia; ks. vahvuuskohtaiset määrät valmisteyhteenvedosta. Yhteisvaikutukset: Samanaikainen plasmanvaihto, plasmafereesi tai IVIg-hoito, ks. valmisteyhteenveto. Raskaus ja imetys: Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja 8 kk hoidon päättymisen jälkeen. Ravulitsumabin käyttöä raskaana oleville naisille voidaan harkita hyöty-riskiarvion jälkeen. Rintaruokinta on lopetettava ravulitsumabihoidon ajaksi ja 8 kuukaudeksi hoidon päättymisen jälkeen. Ajokyky ja koneidenkäyttökyky: Ei haitallista vaikutusta. Haittavaikutukset: Hyvin yleiset (saattaa esiintyä useammalla kuin yhdellä henkilöllä 10:stä): päänsärky, ripuli, ylähengitystieinfektio, flunssa (nuhakuume). Yleiset (saattaa esiintyä enintään yhdellä henkilöllä 10:stä): huimaus, oksentelu, vatsakipu, pahoinvointi, epämukava tunne mahassa aterian jälkeen (ruoansulatushäiriö), nokkosihottuma, ihon kutina, ihottuma, nivelkipu, selkäkipu, lihaskipu ja lihaskouristukset, kuume, influenssan kaltainen sairaus, vilunväristykset, väsymys (uupumus, voimattomuus), infuusioon liittyvä reaktio, virtsatieinfektio. Melko harvinaiset (saattaa esiintyä enintään yhdellä henkilöllä 100:sta): meningokokki-infektio, vakava allerginen reaktio, joka aiheuttaa hengitysvaikeuksia tai huimausta (anafylaktinen reaktio), yliherkkyys, gonokokki-infektio. Yliannostus: Ei raportoituja tapauksia. Pakkaukset ja hinnat: 300 mg/3 ml: Yksi injektiopullo 6112,32 €. 1 100 mg/11 ml: Yksi injektiopullo 22304,30 €. Reseptilääke. Korvattavuus: ei. Lisätiedot: Pharmaca Fennica tai Alexion Europe SAS, 103-105 rue Anatole France, 92300 LevalloisPerret, Ranska. Tutustu valmisteyhteenvetoon ennen lääkkeen määräämistä. Tämä teksti perustuu 13.07.2023 päivättyyn valmisteyhteenvetoon.

