The first and only long-acting treatment for aHUS, providing1,3,4:
*Through 26 weeks; TMA response consisted of platelet count normalization, Serum LDH normalization and ≥25% improvement in serum creatinine from baseline
†54% (30/56; 95% CI: 40-67%) of adult and 77% (14/18; 95% CI: 52.4-93.6%) of pediatric patients met the composite endpoint of complete TMA response
‡Starting 2 weeks after the loading dose, maintenance doses are administered once every 4 or 8 weeks (depending on body weight)

*ULTOMIRIS® is administered as maintenance dose for patients above 20 kg every 8 weeks.
ULTOMIRIS® Mechanism of Action
With its extended half-life2, ULTOMIRIS® minimises the number of infusions
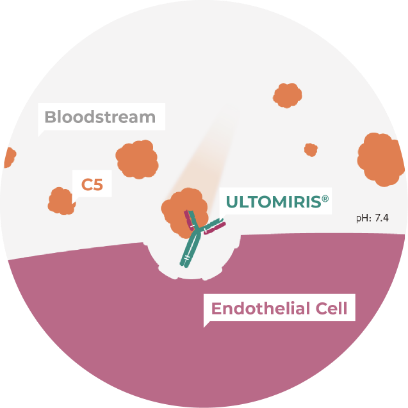
ULTOMIRIS® captures C5 in the bloodstream and prevents its activation2
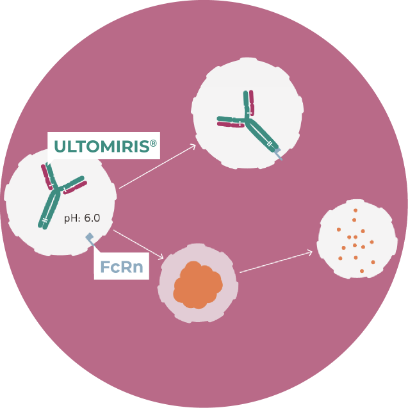
Specifically engineered, ULTOMIRIS® releases C5 in the acidified endosome, leaving C5 to be degraded by the lysosome. This acidified environment also increases the affinity of ULTOMIRIS® for the neonatal Fc receptor (FcRn), enhancing its return to the cell surface via FcRn-mediated recycling2
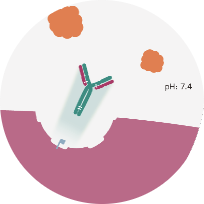
FcRn releases unbound ULTOMIRIS® back into the bloodstream to capture more C52
ULTOMIRIS® captures C5 in the bloodstream and prevents its activation2
Specifically engineered, ULTOMIRIS® releases C5 in the acidified endosome, leaving C5 to be degraded by the lysosome. This acidified environment also increases the affinity of ULTOMIRIS® for the neonatal Fc receptor (FcRn), enhancing its return to the cell surface via FcRn-mediated recycling2
FcRn releases unbound ULTOMIRIS® back into the bloodstream to capture more C52

Ravulizumab has a ~4x longer half-life than that of eculizumab®2§

§§Half-life of ULTOMIRIS® in patients with aHUS is 51.8 (16.2) days; mean elimination half life of eculizumab in aHUS is 12.4 days.

▼ Detta läkemedel är föremål för utökad övervakning.
Ultomiris (ravulizumab) 300 mg/3 ml och 1100 mg/11 ml, koncentrat till infusionsvätska, lösning. Rx, EF. ATC-kod: L04AA43. Selektiva immunsuppressiva medel.Indikationer: Paroxysmal nattlig hemoglobinuri (PNH) hos vuxna och pediatriska patienter med en kroppsvikt på 10 kg eller mer med hemolys med kliniska symtom som tyder på hög sjukdomsaktivitet och hos patienter som är kliniskt stabila efter att ha behandlats med eculizumab under minst de senaste 6 månaderna. Atypiskt hemolytiskt uremiskt syndrom (aHUS) hos patienter med en kroppsvikt på minst 10 kg som är behandlingsnaiva för komplementhämmare eller har fått behandling med eculizumab i minst 3 månader och som har visat behandlingssvar på eculizumab. Tilläggsbehandling till standardterapi hos vuxna patienter med generaliserad myasthenia gravis (gMG)som är positiva för antiacetylkolinreceptorantikropp (se avsnitt 5.1 i SPC). Neuromyelitis optica-spektrumtillstånd (NMOSD) Ultomris är avsett för behandling av vuxna patienter med NMOSD som är positiva för antikroppar mot aquaporin 4 (AQP4) (se avsnitt 5.1). Kontraindikationer: Överkänslighet mot den aktiva substansen eller något hjälpämne. Varningar och försiktighet: På grund av Ultomiris verkningsmekanism ökar patientens mottaglighet för meningokockinfektion(Neisseria meningitidis). och inklusive meningokocksepsis och meningokockencefalit (se avsnitt 4.4).Patienterna måste därför skyddas genom vaccination och eventuellt även antibiotika samt följas avseende tecken på meningit. Se produktresumen för riktlinjer kring vaccination. Behandling får inte påbörjas hos patienter med ej utläkt Neisseria meningitidis-infektion vid behandlingsstart eller som för närvarande inte är vaccinerade mot Neisseria meningitidis såvida de inte får profylaktisk behandling med lämpliga antibiotika fram till 2 veckor efter vaccination. För att minska risk för meningokockinfektion måste alla patienter vaccineras mot meningokockinfektioner minst två veckor före insättning av ravulizumab såvida inte risken med att fördröja ravulizumabbehandlingen överväger risken för att utveckla en meningokockinfektion. Ultomiris måste administreras av vårdpersonal och under överinseende av en läkare som har erfarenhet av att behandla patienter med hematologiska sjukdomar,njursjukdomar eller neuromuskulära sjukdomar. Ultomiris ska endast administreras via intravenös infusion. Se avsnittet Varningar och försiktighet i produktresumén eller på fass.se. Ultomiris ska administreras med försiktighet till patienter med aktiva systemiska infektioner. Innan ravulizumab sätts in rekommenderas att patienter genomgår immunisering enligt gällande vaccinationsriktlinjer. Efter rekommenderad vaccination ska patienter noggrant övervakas för sjukdomssymtom. Med tanke på att NMOSD är en kronisk sjukdom ska patienter som har nytta av behandling med ravulizumab men som avbryter behandlingen övervakas för symtom på NMOSD-skov. Om symtom på NMOSD återkommer efter utsättande bör förnyad behandling med ravulizumab övervägas. Biverkningar: Mycket vanliga (kan förekomma hos fler än 1 av 10 personer): huvudvärk, diarré, illamående, buksmärta, feber (pyrexi), trötthet (utmattning), övre luftvägsinfektion, vanlig förkylning (nasofaryngit), ryggsmärta, ledsmärta (artralgi) Vanliga (kan förekomma hos upp till 1 av 10 personer): yrsel, kräkningar, matsmältningsbesvär (dyspepsi), nässelutslag, hudutslag, klåda i huden (prurit), muskelsmärta (myalgi) och muskelkramper, influensaliknande sjukdom, frossa, svaghet (asteni), infusionsrelaterad reaktion, allergisk reaktion (överkänslighet) Mindre vanliga (kan förekomma hos upp till 1 av 100 personer): meningokockinfektion, allvarlig allergisk reaktion som orsakar andningssvårigheter eller yrsel (anafylaktisk reaktion), gonokockinfektion. Administrering av ravulizumab kan leda till infusionsreaktioner och allergiska reaktioner eller överkänslighetsreaktioner (inklusive anafylaxi). Ultomiris 300 mg/3 ml och 1100 mg/11 ml koncentrat till infusionsvätska, lösning: Efter spädning med natriumklorid 9 mg/ml (0,9 %) lösning för injektion, innehåller detta läkemedel 0,18 g natrium per 72 ml vid maximal dos, motsvarande 9,1 % av WHO:s högsta rekommenderat dagligt intag (2 gram natrium för vuxna). Fertila kvinnor ska använda effektiv preventivmetod under behandling och i upp till 8 månader efter avslutad behandling. För gravida kvinnor kan användningen av ravulizumab övervägas efter en bedömning av risker och nytta. Eftersom många läkemedel och immunglobuliner utsöndras i modersmjölk, och på grund av risken för allvarliga skadliga reaktioner hos ammade spädbarn, ska amning avbrytas under behandling med ravulizumab och i upp till 8 månader efter behandling. Ultomiris har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Kontakt: Alexion Pharma Nordics AB, 08-557 727 50. Se www.fass.se för ytterligare information och priser. Datum för senaste översyn av produktresumén: 2023-07-13

