ULTOMIRIS® is the first and only long-acting C5 inhibitor that is administered every 8 weeks1,2,4,5.





*With ULTOMIRIS® 300 mg/3 mL or 1,100 mg/11 mL concentrate for solution for infusion. Starting 2 weeks after the loading dose, maintenance doses are administered once every 8 weeks. For patients ≥10 to <20 kg, maintenance doses are administered once every 4 weeks.
Mechanism of action
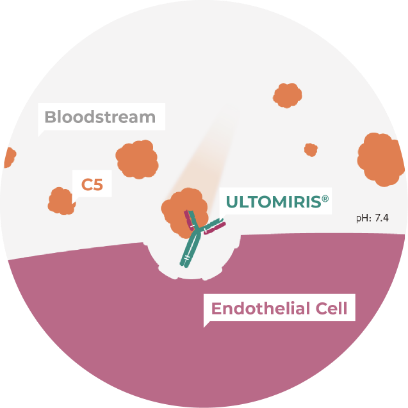
ULTOMIRIS® (ravulizumab) traps C5 in the bloodstream and prevents its activation11
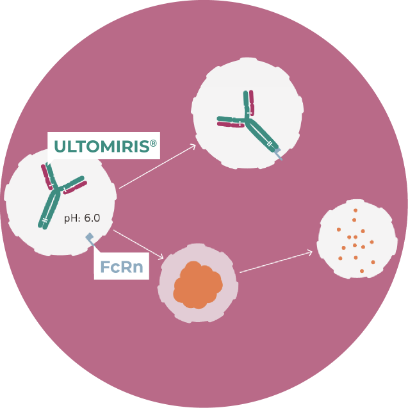
Specially designed, ULTOMIRIS® (ravulizumab) deposits C5 in the acidified endosome, allowing the C5 from the lysosome can be broken down. The acidified environment also improves the binding affinity of ULTOMIRIS® to the neonatal Fc receptor (FcRn) and promotes its return to the cell surface via FcRn-mediated recycling11
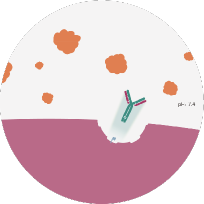
FcRn releases unbound ULTOMIRIS® (ravulizumab) ravulizumab back into the bloodstream in order to increase C5 uptake11

Comprehensive clinical development programme
The effectiveness of ULTOMIRIS® was investigated in the largest clinical study to date of PNH patients4,5,8,9,13
ULTOMIRIS® for the treatment of PNH in adult patients who are complement therapy treatment-naive.4,9,13
ULTOMIRIS® for the treatment of PNH in adult patients previously treated with Eculizumab.5,8,13

Resources
Use of anticoagulants in PNH
Discover why anticoagulants are not sufficient in PNH
IVH, intravascular haemolysis; LDH, lactate dehydrogenase; PNH, paraoxysmal nocturnal haemoglobinuria; ULN, upper limit of normal.
References:
- ULTOMIRIS® Summary of Product Characteristics, July 2023.
- Ristano AM, Marotta S. Toward complement inhibition 2.0: Next generation anticomplement agents for paroxysmal nocturnal hemoglobinuria. Am J Hematol. 2018;93(4):564-577.
- SOLIRIS® EU Summary of Product Characteristics. July 2023.
- Lee JW, et al. Ravulizumab (ALXN1210) vs eculizumab in adult patients with PNH naive to complement inhibitors: the 301 study. Blood. 2019;133(6):530-539.
- Kulasekararaj AG, et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor-experienced adult patients with PNH: the 302 study. Blood. 2019;133(6):540-549.
- Kelly R, Richards S, Hillmen P, Hill A. The pathophysiology of paroxysmal nocturnal hemoglobinuria and treatment with eculizumab. Ther Clin Risk Manag. 2009;5:911-921.
- Jang JH, et al. Predictive Factors of Mortality in Population of Patients with Paroxysmal Nocturnal Hemoglobinuria (PNH): Results from a Korean PNH Registry. J Korean Med Sci. 2016;31(2):214–221.
- Kulasekararaj AG, et al. One-year outcomes from a phase 3 randomized trial of ravulizumab in adults with paroxysmal nocturnal hemoglobinuria who received prior eculizumab. Eur J Haematol. 2021 Mar;106(3):389-397.
- Schrezenmeier H, Kulasekararaj A, Mitchell L, et al. One- year efficacy and safety of ravulizumab in adults with paroxysmal nocturnal hemoglobinuria naive to complement inhibitor therapy: open-label extension of a randomized study. Ther Adv Hematol. 2020:11:20406207209661372019;133(6):540-549.
- Peipert JD, et al. Patient preferences and quality of life implications of ravulizumab (every 8 weeks) and eculizumab (every 2 weeks) for the treatment of paroxysmal nocturnal hemoglobinuria. PLoS ONE. 2020;15(9): e0237497
- Sheridan D, et al. Design and preclinical characterization of ALXN1210: A novel anti-C5 antibody with extended duration of action. PLoS One. 2018 Apr 12;13(4):e0195909.
- Risitano AM, et al. Anti-complement Treatment for Paroxysmal Nocturnal Hemoglobinuria: Time for Proximal Complement Inhibition? A Position Paper From the SAAWP of the EBMT. Front Immunol. 2019;10:1157.
- Kulasekararaj AG, et al. Long-term safety and efficacy of ravulizumab in patients with paroxysmal nocturnal hemoglobinuria: 2-year results from two pivotal phase 3 studies. Eur J Haematol. 2022 Sep;109(3):205-214.
▼ Detta läkemedel är föremål för utökad övervakning.
Ultomiris (ravulizumab) 300 mg/3 ml och 1100 mg/11 ml, koncentrat till infusionsvätska, lösning. Rx, EF. ATC-kod: L04AA43. Selektiva immunsuppressiva medel.Indikationer: Paroxysmal nattlig hemoglobinuri (PNH) hos vuxna och pediatriska patienter med en kroppsvikt på 10 kg eller mer med hemolys med kliniska symtom som tyder på hög sjukdomsaktivitet och hos patienter som är kliniskt stabila efter att ha behandlats med eculizumab under minst de senaste 6 månaderna. Atypiskt hemolytiskt uremiskt syndrom (aHUS) hos patienter med en kroppsvikt på minst 10 kg som är behandlingsnaiva för komplementhämmare eller har fått behandling med eculizumab i minst 3 månader och som har visat behandlingssvar på eculizumab. Tilläggsbehandling till standardterapi hos vuxna patienter med generaliserad myasthenia gravis (gMG)som är positiva för antiacetylkolinreceptorantikropp (se avsnitt 5.1 i SPC). Neuromyelitis optica-spektrumtillstånd (NMOSD) Ultomris är avsett för behandling av vuxna patienter med NMOSD som är positiva för antikroppar mot aquaporin 4 (AQP4) (se avsnitt 5.1). Kontraindikationer: Överkänslighet mot den aktiva substansen eller något hjälpämne. Varningar och försiktighet: På grund av Ultomiris verkningsmekanism ökar patientens mottaglighet för meningokockinfektion(Neisseria meningitidis). och inklusive meningokocksepsis och meningokockencefalit (se avsnitt 4.4).Patienterna måste därför skyddas genom vaccination och eventuellt även antibiotika samt följas avseende tecken på meningit. Se produktresumen för riktlinjer kring vaccination. Behandling får inte påbörjas hos patienter med ej utläkt Neisseria meningitidis-infektion vid behandlingsstart eller som för närvarande inte är vaccinerade mot Neisseria meningitidis såvida de inte får profylaktisk behandling med lämpliga antibiotika fram till 2 veckor efter vaccination. För att minska risk för meningokockinfektion måste alla patienter vaccineras mot meningokockinfektioner minst två veckor före insättning av ravulizumab såvida inte risken med att fördröja ravulizumabbehandlingen överväger risken för att utveckla en meningokockinfektion. Ultomiris måste administreras av vårdpersonal och under överinseende av en läkare som har erfarenhet av att behandla patienter med hematologiska sjukdomar,njursjukdomar eller neuromuskulära sjukdomar. Ultomiris ska endast administreras via intravenös infusion. Se avsnittet Varningar och försiktighet i produktresumén eller på fass.se. Ultomiris ska administreras med försiktighet till patienter med aktiva systemiska infektioner. Innan ravulizumab sätts in rekommenderas att patienter genomgår immunisering enligt gällande vaccinationsriktlinjer. Efter rekommenderad vaccination ska patienter noggrant övervakas för sjukdomssymtom. Med tanke på att NMOSD är en kronisk sjukdom ska patienter som har nytta av behandling med ravulizumab men som avbryter behandlingen övervakas för symtom på NMOSD-skov. Om symtom på NMOSD återkommer efter utsättande bör förnyad behandling med ravulizumab övervägas. Biverkningar: Mycket vanliga (kan förekomma hos fler än 1 av 10 personer): huvudvärk, diarré, illamående, buksmärta, feber (pyrexi), trötthet (utmattning), övre luftvägsinfektion, vanlig förkylning (nasofaryngit), ryggsmärta, ledsmärta (artralgi) Vanliga (kan förekomma hos upp till 1 av 10 personer): yrsel, kräkningar, matsmältningsbesvär (dyspepsi), nässelutslag, hudutslag, klåda i huden (prurit), muskelsmärta (myalgi) och muskelkramper, influensaliknande sjukdom, frossa, svaghet (asteni), infusionsrelaterad reaktion, allergisk reaktion (överkänslighet) Mindre vanliga (kan förekomma hos upp till 1 av 100 personer): meningokockinfektion, allvarlig allergisk reaktion som orsakar andningssvårigheter eller yrsel (anafylaktisk reaktion), gonokockinfektion. Administrering av ravulizumab kan leda till infusionsreaktioner och allergiska reaktioner eller överkänslighetsreaktioner (inklusive anafylaxi). Ultomiris 300 mg/3 ml och 1100 mg/11 ml koncentrat till infusionsvätska, lösning: Efter spädning med natriumklorid 9 mg/ml (0,9 %) lösning för injektion, innehåller detta läkemedel 0,18 g natrium per 72 ml vid maximal dos, motsvarande 9,1 % av WHO:s högsta rekommenderat dagligt intag (2 gram natrium för vuxna). Fertila kvinnor ska använda effektiv preventivmetod under behandling och i upp till 8 månader efter avslutad behandling. För gravida kvinnor kan användningen av ravulizumab övervägas efter en bedömning av risker och nytta. Eftersom många läkemedel och immunglobuliner utsöndras i modersmjölk, och på grund av risken för allvarliga skadliga reaktioner hos ammade spädbarn, ska amning avbrytas under behandling med ravulizumab och i upp till 8 månader efter behandling. Ultomiris har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Kontakt: Alexion Pharma Nordics AB, 08-557 727 50. Se www.fass.se för ytterligare information och priser. Datum för senaste översyn av produktresumén: 2023-07-13



